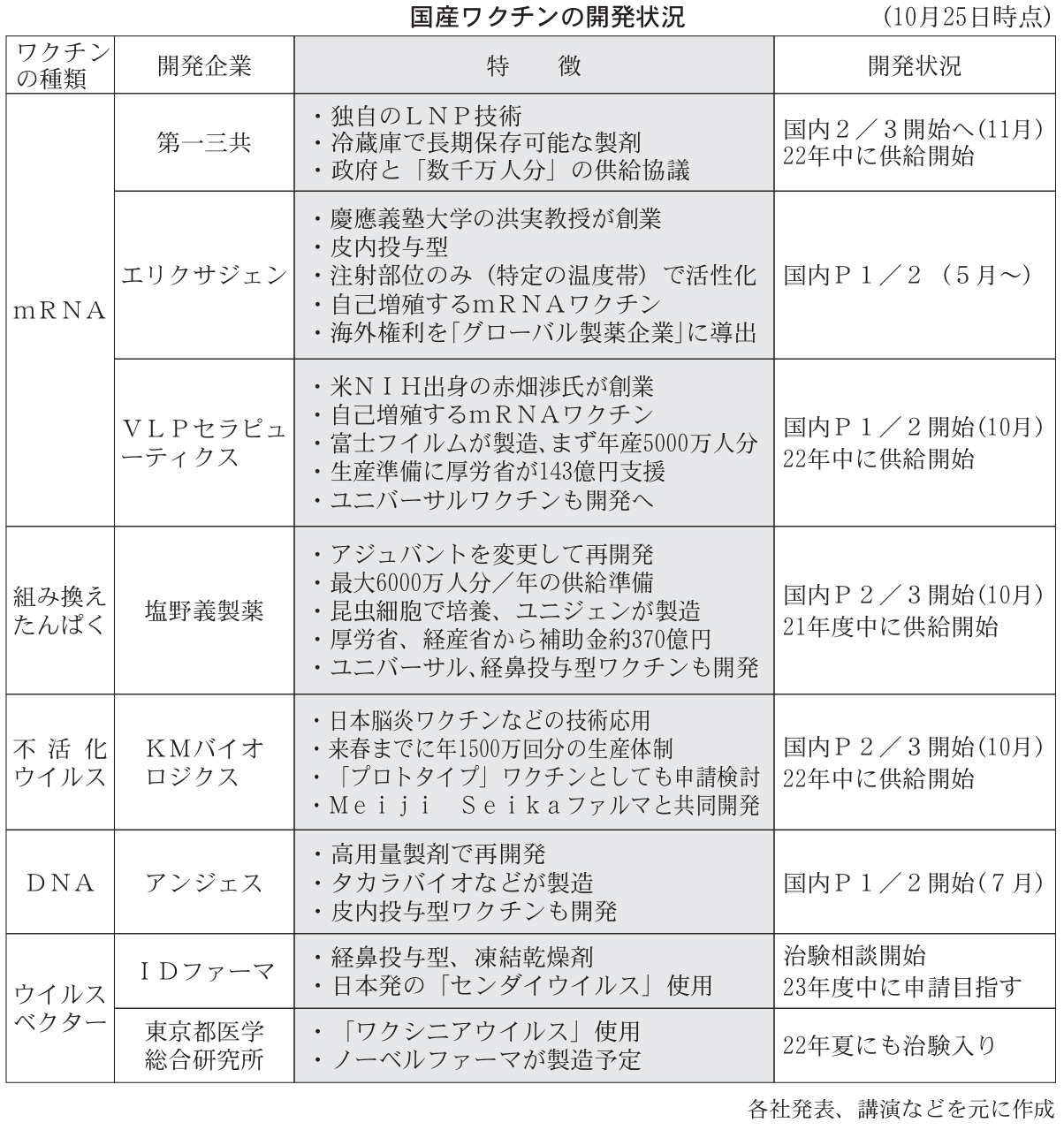
国内製薬企業による新型コロナウイルスワクチンの開発が、後期段階に進んできた。塩野義製薬、KMバイオロジクス、第一三共は、第1段階の臨床試験(治験)で良好な結果を得たとして第2段階の治験に着手。大規模な最終治験や追加接種の試験なども立ち上げ、来春から2022年度にかけて実用化を目指す。ベンチャーも大手企業の協力などを得て、大量生産や実用化への道筋がみえてきた。承認申請に必要なデータもみえてきた今後、国産ワクチンも先行する海外勢と同等以上の安全性、有効性を証明できるか注目される。
先週以降、国内製薬各社が国産コロナワクチンの新たな治験計画を相次ぎ発表した。塩野義は3000人規模、KMバイオは2000人規模の第2/3相臨床試験(P2/3)を開始。比較する対照薬を設定しない試験で、P1/2で確認した安全性や免疫原性などを再確認する。第一三共も来月に同様のP2/3を開始する。3社とも年内~来年3月までにさらに大規模な臨床試験をP3として始める予定。塩野義は「来春」、KMバイオと第一三共は「22年中」の供給開始を目指す。塩野義は年内に3000万~6000万人分、KMバイオは来春までに1500万回分の生産能力を整備。第一三共も数千万人分の供給体制を目指す。
2番手集団では、ベンチャー創製品も控えている。米エリクサジェン・セラピューティクスは今月、日本以外の製品化権利を「グローバル製薬企業(社名非開示)」に導出したと発表。P1/2は5月から日本で実施している。米VLPセラピューティクスも今月からP1/2を開始した。治験薬は富士フイルムが製造する。両社とも日本人研究者らが米国で立ち上げた創薬ベンチャー。接種後、体内でRNAが増殖する次世代型のmRNAワクチンを開発する。
治験ラッシュの背景には、薬事当局の方針転換もある。すでに国民の約7割が2回接種を終え、感染報告も激減している。日本だけで数千~数万人を集めて実際の予防効果をプラセボ(偽薬)と比較するような治験を複数、行うのは難しい。そこで医薬品医療機器総合機構(PMDA)は先週、新たな開発指針を発表し、承認申請までに求める後期段階の治験要件を緩和した。米ファイザー製など既承認のワクチンと比較して抗体価に基づく免疫反応が同等以上であることを証明できれば申請を受け付ける方針だ。
後期開発のハードルが下がったとはいえ、来春以降に計画通り国産ワクチンを実用化できるかは、今後出てくる治験データにかかっている。塩野義など3社はP1/2で計画していた安全性や免疫原性を確認できたとしているが、具体的な数値はほとんど開示されていない。
ファイザー製などで出ている高い有効率もハードルを上げている。昨年6月に国内1番手で治験入りしたアンジェスは、当初の用量ではファイザー製のようなレベルの抗体価が見込めないとして用量を変更。高用量製剤でP1/2を追加実施している。塩野義も、最初のP1/2を行った製剤では抗体価が不十分と判断し、効果を高めるアジュバントを変更した新製剤で再開発している。(赤羽環希)